Overzicht
Lithiumbatterijen worden nu op veel gebieden gebruikt, en in het verleden, loodzuurbatterijen, cadmium-batterijen, en nikkelbatterijen werden op deze gebieden gebruikt. Dit artikel introduceert de ontwikkelingsgeschiedenis van lithium-ionbatterijen en gerelateerde kennis van de structuur van lithium-ionbatterijen, gericht op lezers die geïnteresseerd zijn in of aankoopbehoeften hebben voor lithium-ionbatterijen, om hen te helpen verstandigere keuzes te maken bij de aanschaf van batterijen.

1. De ontwikkelingsgeschiedenis van lithium-ionbatterijen
In het afgelopen decennium, Lithium-ionbatterijen zijn in bijna alle industrieën het dominante chemische materiaal voor oplaadbare batterijen geworden. Vergeleken met de voorheen populaire chemische materialen (loodzuurbatterijen, nikkel-cadmium-batterijen, en alkalische batterijen), Lithium-ionbatterijen zijn in veel opzichten superieur. Lithium is momenteel het chemische materiaal met de hoogste gebruikte energiedichtheid, en met enkele extra functies, het kan het veiligste chemische materiaal worden. Lithium-energie is een actief onderzoeksveld, daarom worden er elk jaar nieuwe chemische materialen ontwikkeld.
Het concept van lithium-ionbatterijen werd voor het eerst voorgesteld in de jaren zeventig, toen de Britse chemicus Stanley Whittingham een batterij uitvond die zichzelf na verloop van tijd kon opladen. Hij probeerde titaniumdisulfide en lithiummetaal als elektroden te gebruiken, maar dit zorgde ervoor dat de batterij kortsluiting maakte en explodeerde.
De veiligheidsproblemen van lithium-metaalbatterijen hebben geleid tot de ontwikkeling van lithium-ionbatterijen. Hoewel lithium-metaalbatterijen een hogere energiedichtheid hebben, Lithium-ionbatterijen zijn zeer veilig bij het opladen en ontladen volgens specifieke veiligheidsrichtlijnen.
In de jaren tachtig, John Goodenough en Akira Yoshino experimenteerden verder om batterijen veiliger te maken. De ontwikkeling van lithium-ionbatterijen is dus begonnen.

In de jaren negentig, Lithium-iontechnologie kreeg de voorkeur en werd snel populair. In die tijd, Sony produceerde de eerste batch commerciële batterijen, markeert het begin van de commercialisering van lithium-ionbatterijen. Tegelijkertijd, de markt voor draagbare elektronische apparaten groeit snel, vereist een lichtgewicht oplaadbare batterij om hem van stroom te voorzien. Lithium-ionbatterijen, als een veilige en krachtige batterij, zijn de beste keuze geworden.
In het afgelopen decennium, Lithium-ionbatterijen zijn in bijna alle industrieën het dominante chemische materiaal voor oplaadbare batterijen geworden. Vergeleken met de voorheen populaire chemische materialen (loodzuurbatterijen, nikkel-cadmium-batterijen, en alkalische batterijen), Lithium-ionbatterijen zijn in veel opzichten superieur. Lithium is momenteel het chemische materiaal met de hoogste gebruikte energiedichtheid, en met enkele extra functies, het kan het veiligste chemische materiaal worden. Lithium-energie is een actief onderzoeksveld, daarom worden er elk jaar nieuwe chemische materialen ontwikkeld.
Momenteel, de top vijf van wereldwijde bedrijven voor lithium-ionbatterijtoepassingen Zijn:
KAT (China)
LG Chem (Zuid-Korea)
DOORD (China)
Panasonic (Japan)
Samsung SDI (Zuid-Korea)
2. Structuur van de lithiumionbatterij
2.1 Wat is een lithium-ionbatterij
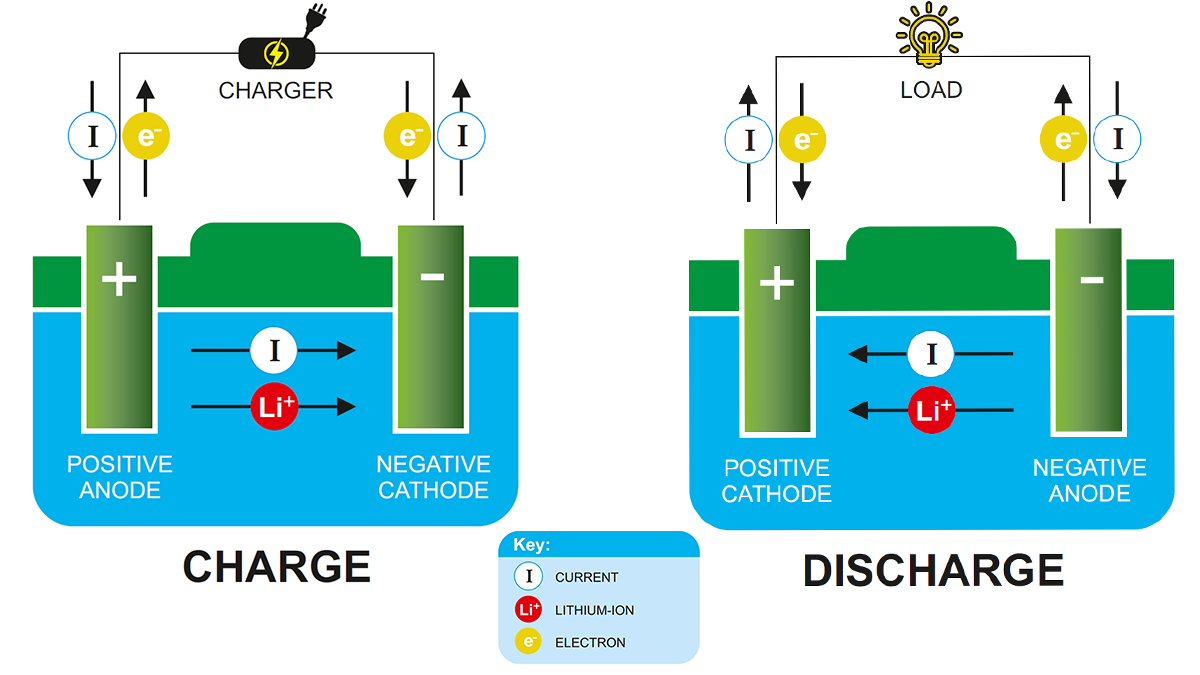
Simpel gezegd, A lithium-ionbatterij verwijst naar een batterij met een negatieve elektrode (anode) en een positieve elektrode (kathode), waar lithiumionen tussen de twee materialen worden getransporteerd. Het werkingsprincipe van lithium-ionbatterijen is hetzelfde als dat van elke andere oplaadbare batterij.
Tijdens ontslag, Lithiumionen verplaatsen zich van de anode naar de kathode en zetten zich af (insluiten) in de positieve elektrode bestaande uit lithium en andere metalen. Bij het opladen, dit proces is het tegenovergestelde.
Elke lithium-ionbatterij heeft een spanningsbereik dat veilig kan werken. Het bereik is afhankelijk van de chemische samenstelling van het elektrolyt dat in de batterij wordt gebruikt. Bijvoorbeeld, LFP-batterijen zijn 2,5V bij 0% staat van lading (SOC) en 3,6V bij 100% SOC. Dit wordt doorgaans beschouwd als het veilige werkbereik van LFP-batterijen, terwijl onder het gespecificeerde bereik wordt beschouwd als overmatige ontlading, en het overschrijden van de gespecificeerde 100% SOC wordt beschouwd als overladen.
2.2 structuur van de lithium-ionbatterij
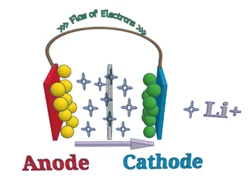
2.2.1 Anode
De anode is de negatieve elektrode in een batterij. In lithium-ionbatterijen, de anode bestaat meestal uit lithium en koolstof (meestal grafietpoeder). De zuiverheid, deeltjesgrootte, en een uniforme verdeling van anodematerialen kunnen allemaal hun capaciteit en verouderingssnelheid beïnvloeden.
2.2.2 Kathode
De kathode is de positieve elektrode. Dit is waar verschillende chemicaliën een rol spelen. De kathode bepaalt de algemene chemische eigenschappen van lithiumenergie. Zoals de anode, de collector wordt gecombineerd met het materiaal om elektronische reactieactiviteit te vergemakkelijken. Het belangrijkste verschil tussen beide ligt in de temperatuur waarbij verschillende chemicaliën reageren met elektrolyten (thermische vluchteling) en de grootte van de spanning die ze produceren.
2.2.3 Elektrolyten
Elektrolyten zorgen ervoor dat lithiumionen tussen de twee platen kunnen worden overgebracht en verplaatst. Gebruikelijk, het is samengesteld uit verschillende organische carbonaten, zoals ethyleencarbonaat en diethylcarbonaat. De verschillende mengsels en verhoudingen zijn afhankelijk van de toepassingsomgeving van de batterij.
Bijvoorbeeld, voor toepassingen bij lage temperaturen, de viscositeit van de elektrolytoplossing zal lager zijn dan die van de elektrolytoplossing bij kamertemperatuur. Bij lithiumbatterijen, lithiumhexafluorfosfaat (LiPF6) is het meest voorkomende lithiumzout. Er kan worden gezegd dat de meest gebruikte elektrolyt in lithium-ionbatterijen lithiumhexafluorfosfaat is (LiPF6), waarvan de kwaliteit de laad- en ontlaadprestaties bepaalt, levensduur, en veiligheid van lithium-ionbatterijen.
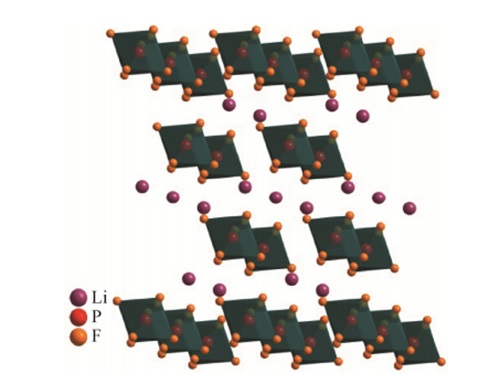
Omdat LiPF6 de beste algehele uitgebreide prestaties heeft, het heeft een uitstekende milieuvriendelijkheid, passivatie van de stroomcollector van de positieve elektrode om elektrodecorrosie te voorkomen, en wanneer gemengd met water, het produceert fluorwaterstofzuur (HF), wat bevorderlijk is voor de vorming van SEI-film op de negatieve elektrode.
SEI is een chemische reactie tussen lithiummetaal en elektrolyt, die een vaste elektrolytlaag vormt op het oppervlak van lithiummetaal. Het speelt een rol bij de isolatie en bescherming tussen lithiummetaal en elektrolyt.
Onder normale omstandigheden, Batterijfabrikanten laden doorgaans langzaam op om een uniforme SEI op de koolstofanode te vormen.
2.2.4 Diafragma
De separator van lithium-ionbatterijen is een poreuze plastic film die het voorkomen van direct contact tussen de anode en kathode vergemakkelijkt. Deze dunne films zijn meestal 20 micron dik met kleine poriën waardoor lithiumionen kunnen passeren tijdens laad- en ontlaadprocessen. Zodra de batterij het temperatuurbereik overschrijdt of kortsluiting ervaart, deze afscheider sluit de poriën en voorkomt dat lithiumionen erdoorheen gaan, waardoor de chemische reactie wordt gestopt.
3. De voordelen van lithium-ionbatterijen
3.1 voordelen van lithium-ionbatterijstructuur
1. Hoge ontlading, stabiele capaciteit
2.Snel opladen
Lithium-ionbatterijen – binnenin opgeladen 1 uur
Loodzuurbatterijen – voorbij 9 uur
3.Kleine voetafdruk en sterk draagvermogen
4.Meerdere cycli en lange levensduur
Lithium-ionbatterijen – De levensduur is meestal 5000 keer, en volledige ontlading heeft geen invloed op de levensduur van de cyclus
Loodzuurbatterijen -300 naar 500 keer, volledige ontlading zal hun levensduur beïnvloeden
5.Hoge energie-efficiëntie
Lithium-ionbatterijen -96% uitgang, 4% warmteverlies
Loodzuurbatterijen -15% warmteverlies bij 85% uitgang
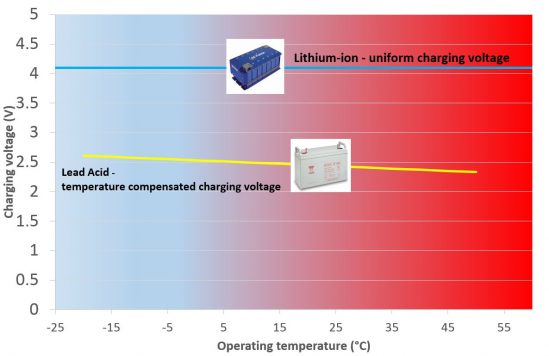
6.Breed scala aan laadspanningen
Geen spanningscompensatie vereist
7.Verlaag de kosten voor thermisch beheer
Lithium-ionbatterijen – acceptabele luchtcirculatie
Loodzuuraccu – vereist airconditioning
8.Geen gasuitstoot
Lithium-ionbatterijen – werken in afgesloten containers
Loodzuurbatterijen – vereisen waterstofventilatie
9.Niet giftig, geen recyclingbeperkingen
Groene nieuwe energie, veilig en veilig te gebruiken.
Voor meer vergelijking tussen lithiumbatterij en loodzuurbatterij, klik om te bekijken: Lithiumbatterij versus. Lood zuur batterij voor meer gedetailleerde en specifieke inhoud.
3.2 De reden om ervoor te kiezen om loodzuuraccu’s te vervangen door lithium-ionaccu’s
3.2.1 Verbetering van de efficiëntie
Dankzij de vooruitgang op het gebied van gebouwbeheersystemen en laadtechnologie, Voedingsapparatuur met lithium-ionbatterijen kan de efficiëntie helpen verbeteren en de uitvaltijd verminderen die wordt veroorzaakt door de noodzaak om apparatuur op batterijen op te laden.
3.2.2 Verbetering van de productiviteit
Operators hoeven zich geen zorgen te maken over problemen met het opladen van apparaten, en lithium-ionbatterijtechnologie stelt bedrijven in staat te investeren in automatiseringsoplossingen, het verlagen van de kosten voor bedrijven.
3.2.3 Een eenvoudigere manier om op te laden en op te slaan
Lithium-ionbatterijen kunnen op elk moment worden opgeladen, wat betekent dat u ze op uw gemak kunt opladen. Lithium-ionbatterijen hebben ook geen eigen oplaad- of opslagruimte nodig, omdat ze geen milieurisico's met zich meebrengen, zoals loodzuurbatterijen.
3.2.4 Geen onderhoud nodig
In tegenstelling tot loodzuurbatterijen, Lithium-ionbatterijen vereisen geen vervelende inspecties en onderhoudsmethoden.
3.2.5 Verbetering van de operationele veiligheid
Lithium-ionbatterijen verbeteren op verschillende manieren de operationele veiligheid van faciliteiten, en ze zijn ook milieuvriendelijker vanwege het lagere risico op oververhitting, explosie, of uitstoot van schadelijke gassen of vloeistoffen.
4.1 Gebalanceerd opladen
Overlaad de batterij na een volledige laadcyclus boven de normale spanning. Deze stap is nodig om opgehoopte sulfaten te helpen verwijderen en de spanning van elke batterij in loodzuurbatterijen in evenwicht te brengen.
4.2 Verslechtering van de batterij
Het proces waarbij de hoeveelheid energie die een batterij kan opslaan, wordt verminderd. Temperatuur, laad- en ontlaadspanning, en de laad- en ontlaaddiepte kan van invloed zijn op de mate waarin de batterijcapaciteit in de loop van de tijd afneemt.
4.3 Aantal batterijcycli
Als de batterij één keer wordt opgeladen en ontladen als een cyclus, het cumulatieve aantal ladingen en ontladingen. De batterijcyclus bestaat uit 100% ontladen en opladen.
4.4 Levensduur van de batterij
Hoe lang kan de batterij worden gebruikt binnen zijn levensduur?. De levensduur wordt gemeten aan de hand van het aantal volledige cycli van opladen en ontladen.
4.5 Werktemperatuur
De aanvaardbare temperatuur van de omgeving waarin de batterij werkt. Als de werktemperatuur het bereik overschrijdt, de batterij kan defect raken.
4.6 UL-vermelding/certificering
UL-lijst/certificering betekent dat UL productmonsters heeft geëvalueerd om er zeker van te zijn dat ze aan specifieke eisen voldoen. Dit omvat testmonsters die de functionele veiligheid en gebruiksscenario's van de lithium-ionbatterijstructuur bestrijken.
5. Waarom kiezen voor lithiumionen- Analyse vanuit het perspectief van de structuur van de lithiumionbatterij

5.1 Uitstekende kwaliteit
De hoge energiedichtheid en uitgebreide ontlaadcycli van lithium-ionbatterijen zijn de belangrijkste factoren, waardoor ze onmisbaar zijn op veel apparaten. En ze zijn ook in veel andere opzichten superieur aan de traditionele batterijchemie. Naast de hoge energiedichtheid van batterijen, ze kunnen ook op hoog vermogen ontladen en snel opladen. Dit geeft ze een grotere operationele flexibiliteit dan loodzuurbatterijen.
In toepassingsscenario's waar het laadvermogen of de oplaadtijd krap zijn, zoals fotovoltaïsche zonne-energiesystemen, continu gebruik in gedeeltelijk opgeladen toestand zal geen schade toebrengen aan lithium-ionbatterijen.
5.2 Milieuvriendelijk
De interactie tussen lithium-ionbatterijen en het milieu is zeer mild. Tijdens het opladen komen er geen schadelijke gassen vrij, en het warmteverlies is zeer laag. Dit betekent dat lithium-ionbatterijen in gesloten ruimtes kunnen worden gebruikt, volledig geïsoleerd van de omgeving. Ook het recyclen en hergebruiken van afgedankte batterijen is erg handig, omdat ze geen giftige stoffen zoals cadmium bevatten, kwik, en leiden.
5.3 Meerdere soorten constructies
Tijdens ontslag, de lading beweegt door het externe circuit tussen de batterijelektroden. Om de ladingsoverdracht binnen de batterij in evenwicht te brengen, positief geladen lithiumionen bewegen door een intern elektrolytcircuit tussen de positieve en negatieve elektroden. Bij het opladen, het proces is omgekeerd, en lithiumionen keren terug door de elektrolyt.
Als kathode kunnen meerdere soorten chemicaliën worden gebruikt (kathoden) om elektrodematerialen te vervaardigen die lithiumionen dragen. Elektrolytmaterialen zijn ook een onderzoeksrichting, en de toestand van materialen zoals vaste stoffen en vloeistoffen is ook een onderzoeksonderwerp. Dit is een zeer actief onderzoeks- en ontwikkelingsgebied, die de ontwikkeling van lithium-ionbatterijen in steeds meer markttoepassingen stimuleert.
Conclusie
Nu je zoveel analyses en gegevens hebt begrepen, u moet een bepaald begrip hebben van lithiumbatterijen: hun geschiedenis, voordelen, en ontwikkelingsrichting.
De toekomst van elektrische producten is aangebroken. De vraag naar de transitie van traditionele energie naar nieuwe energie kan niet worden genegeerd. Nu steeds meer industrieën en ondernemingen de voordelen van lithium-ionbatterijtechnologie inzien, het nemen van beslissingen om de bedrijfsfocus te verleggen is eenvoudiger geworden.
Neem contact met ons op, GYCX one-stop-service biedt de meest perfecte oplossing voor uw behoeften.
Bent u van plan om nu te investeren in lithium-ionbatterijtechnologie??
FAQ
1. Kunnen lithiumbatterijen alkalibatterijen vervangen??
Hoewel lithiumbatterijen duurdere batterijtechnologie gebruiken, hun vermogen om een hoge spanning te behouden betekent dat ze een uitstekend alternatief zijn voor alkalibatterijen.
2.Zullen lithiumbatterijen lekken??
Lithiumbatterijen lekken niet, ze zijn dus zeer veilig op te bergen.
Lithium kan vlam vatten als het in contact komt met lucht of water. Ze lekken minder snel vanwege vloeibare elektrolyten, De technologie voor de behandeling van uitlaatgassen is al zeer volwassen.
3.Bij welke temperatuur ontploffen lithium-ionbatterijen??
Lithiumbatterijen kunnen ontploffen 538 graden Celsius.
Als een lithiumbatterij gedurende lange tijd wordt verwarmd, het mag. Omdat lithium-ionbatterijen een zeer hoge energie hebben, als ze heet worden, ze geven organische oplosmiddelen vrij die op de elektrolyt inwerken; Door deze hitte kunnen ze exploderen.
Kortsluiting die optreedt wanneer accupolen in contact komen met metaal, kan ook explosies veroorzaken.
